Sorry. This article is written in Japanese text only.
常陽新聞連載記事『ふしぎを追ってー研究室の扉を開く』 総集編
理化学研究所筑波研究所の、一般読者向けの研究紹介記事は、
「ふしぎを追って-研究室の扉を開く(PDF 13MB)」
平成22年8月25日~23年4月6日の間常陽新聞に連載されました。
リソースとゲノム
カエルの子はなぜカエルになる?
2001年、理化学研究所は、つくば市にバイオリソースセンター(BRC)を立ち上げ、バイオリソース(生物遺伝資源。実験用の生物)の収集と提供を行っています。この理研BRCシリーズの最初の4回は、なぜバイオリソースが研究にとって重要なのか、どのようにバイオリソースを収集整備開発しているのか、「ゲノム」をキーワードにしながら紹介します。
新聞やテレビでよく見かける「ゲノム」「DNA」そして「遺伝子」。よくいっしょに使われます。何が違うのでしょう?「ヒトゲノム計画」によってヒトの成り立ちを記した設計図がすべて解読されたと言われていますが、設計図というのはどういうことでしょう?解読されて何がわかったのでしょうか?
ヒトゲノムという言葉で表されるように、それぞれの生物は固有の「ゲノム」をもっています。カエルはカエル独自のゲノムを持ち、マウスはマウスのゲノムをもちます。そして、アメーバや菌のような単細胞生物から、動物はもちろん植物にいたるまですべての生物が、それぞれ固有のゲノムを持っていて、親から子に、また細胞から細胞に正確に、その「設計図」が複製され伝わっていきます。だから「カエルの子はカエル」になるのです。
このゲノムを作っている物質が「DNA」です。デオキシリボ核酸の頭文字を取ってDNAと呼んでいます。「水」を化学的に「H2O」と記載するのと同じように、ゲノムを化学的に記載する言葉が「DNA」です。すなわち水はH2Oという最小単位の集まりであるように、ゲノムはDNAという分子からできています。
では「遺伝子」とは何でしょう。エンドウマメが丸くなるか、しわになるか、また背が高くなるか低くなるか、といった親から子に伝わって遺伝する形質を決める「因子」を、18 世紀半ばすぎにメンデルが発見しました。その後、20 世紀に入ってこの「因子」のことを「遺伝子」と呼ぶようになりました。ゲノムは親から子に正確に複製され受け継がれていきます。そして、メンデルが発見した遺伝子も、親から子に正確に受け継がれていきます。次回は、この「ゲノム」「DNA」「遺伝子」の関係をさらに掘り下げてみましょう。

( 新規変異マウス研究開発チーム 権藤洋一)
メンデルが認められなかったのはなぜ?
生き物は持つゲノムで生物種が決まると、前回紹介しました。
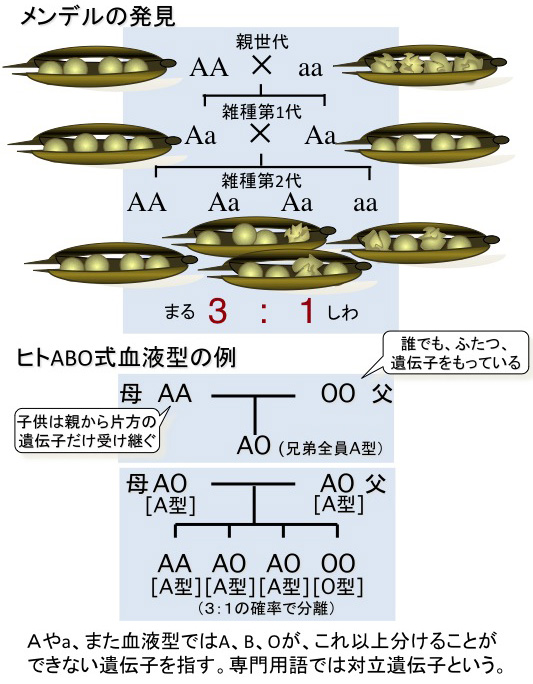
ゲノムには、その生物種を成り立たせるすべての遺伝子が記載されています。遺伝の法則を最初に発見したのはメンデルです。雑種第1代では優性形質(注)のみ子に表れ、その子どうしを交配した雑種第2代では、両親の形質が3対1に分離する、という簡単なものです(図参照)。
メンデルはこの仕組みを、親から子へ受け継がれる「これ以上分けることができない最小因子」を仮定して簡単に説明したのです。誰でも「因子」を2個持っている。親はそのうち1個だけ50%の確率で子に伝える、というのがその仮定です。ちょうど、水がこれ以上分けることができないH2Oという分子からできているように、遺伝も最小単位「遺伝子」で伝わるという「粒子説」を唱えたのです。メンデルは1865年にこの発見を発表しましたが、全く認められませんでした。「遺伝」という現象は有史以前から誰でも知っていたものの、片方の親にだけ似るとか、また、兄弟で3対1に分離することはほとんどなかったからです。通常は、受け継ぐ度合いが強かったり弱かったりと複雑かつ連続的に、ちょうど、濃い色と薄い色をした液体が微妙に混じり合うように伝わるとする「遺伝の液体説(=混合説)」が主流だったのです。
しかし、メンデルの法則に従うケースも少しずつ見つかり、ついに1900年、3人の生物学者によってメンデルの法則が再発見されました。ヒトでもABO式血液型がメンデルの法則に従って遺伝することがわかり、「メンデル遺伝」の一般性が認められました。
一方で、従来から知られていた「液体説」を「非メンデル遺伝」と呼んで区別するようになりました。ヒトの身長などがこの「非メンデル遺伝」の例としてよく挙げられます。では、なぜメンデルは遺伝の法則を発見できたのでしょう。メンデル自身は、彼が考え出した遺伝の「最小因子」が何であるか、どこにあるか、何をしているか全く知りませんでした。「バイオリソース」という概念もありませんでしたが、メンデルが法則を発見できた理由は、まさに、エンドウマメを遺伝子の概念からバイオリソースとしてしっかり品質管理運用したからだったのです。
【注】優性/劣性:持っている対立遺伝子が異なるとき、片方の形質のみ現れる場合が多く、現れる方を「優性形質」、隠れる方を「劣性形質」という。現れる方の対立遺伝子が「優れている」ことは全くないので、「優性」「劣性」という標記は不適切、と学会などでも広く認識されているものの、日本の遺伝学で長く使われてきたため、いまでも「優性/劣性」と記載されている。
( 新規変異マウス研究開発チーム 権藤洋一)
遺伝子の発見はバイオリソースが鍵!?
ヒトゲノムには全遺伝子がDNA分子として記載されています。
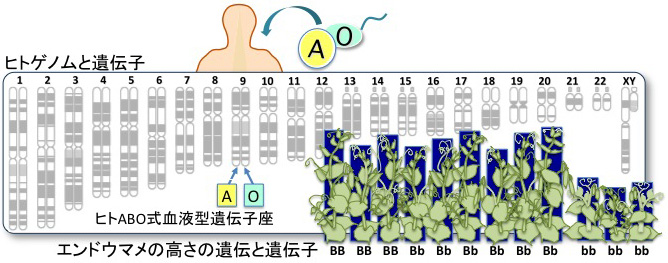
DNAは、細胞核のなかの染色体に折りたたまれて入っています。受精卵は、両親から23本ずつ合計46本の染色体としてゲノムを受け継ぎます。細胞分裂を繰り返して大人になると細胞の数は60兆にもなります。そのすべての細胞が同じ染色体DNA46本を受け継ぎます。卵と精子だけが例外的に1セット23本の染色体を持っています。ABO式血液型の遺伝子は、第9染色体の端にあります。この決まった場所を「遺伝子座」と呼びます。「ゲノム計画からヒトは3万弱の遺伝子を持っていることがわかった」というのは遺伝子座の数のことです。ABO式血液型遺伝子座にはAかBかOの「対立遺伝子」のどれかが入っています。このように、ある遺伝子座に違った対立遺伝子が存在することを「多型(たけい)」がある、といいます。多型によって種内でも個体どうしの違い「個性」が生じます。ふたご(一卵性双生児)がそっくりなのは、多型がまったくないからなのです。
さて、遺伝そのものは有史以前からよく知られ「育種」に利用されてきました。イヌの品種や米 や麦の改良は、遺伝交配を重ねて得られてきました。何万年以上も遺伝を利用しながらメンデルの法則が発見されたのは1865年でした。しかも認められたのは1900年でした。遺伝の本質を明らかにしたメンデルの常識破りの発見には、バイオリソースの整備開発と維持が不可欠でした。メンデルはまず「純系」というリソースを確立しました。BBやbbといった同じ対立遺伝子をもつ系統です。しかし、これだけではメンデルは法則を発見できませんでした。
図にエンドウマメの高さが3対1に分離した例を示していますが、高いものどうしや低いものどうしでも少しずつ高さが違います。この微妙な違いは、栄養や日光などの環境要因に加え、高さを司るもっとたくさんの遺伝子座の複雑な組み合わせによって決まっています。メンデルの「高さの遺伝子座」は、実はそのひとつにすぎません。ただし、たくさんのほかの遺伝子座の多型がどのような組み合わせになっても、メンデルが発見した遺伝子座の多型が突出した違いをもたらすため、メンデルは遺伝の法則を発見できたのです。
図 両親からもらったゲノム2セットはほぼ同じDNA配列を持つ。ということは微妙に違う個所もあり、それが「多型」である。多型は何百万カ所もあり全く同じ組み合わせをもつのは一卵性双生児だけである。
( 新規変異マウス研究開発チーム 権藤洋一)
ふたごも実はウリ二つじゃなかった?
AAとaaのように、かけ離れた形質を示すエンドウマメの「純系」を用いて、メンデルは歴史に残る大発見をしました。バイオリソースの開発と維持管理を踏まえた生命科学が、ここから始まったといってよいでしょう。しかし、実は「純系」は世の中に存在しないのです。DNA配列は正確に複製されます。そのために細胞から細胞へ、親から子へ全く同じゲノムが伝わると紹介しました。しかしDNAには突然変異が生じます。そのために新しい生物種が現われ生命進化が起こります。放射線や化学変異原(註)による突然変異はよく知られていますが、極めてわずかながら自然にも突然変異が生じます。そして、ヒトのゲノムDNA配列は30億文字という膨大な数なので、1回細胞が分裂するたびに平均30文字の違いがゲノムDNA1セットに蓄積されると言われています。
この自然突然変異によって、純系の親子どうしといえども数十から数百文字はDNA配列が違っています。厳密には、純系は存在しないのです。そこで、メンデルのように近親交配して確立した系統を「ほぼ純系」という意味で「近交系」と呼びます。近交系というバイオリソースを用いれば、誰でも同じ材料で実験を行うことが可能です。とはいえ、毎世代新しい突然変異がごくわずかでも蓄積されますので、その維持と品質管理はたいへんです。
地球上には38億年の進化を経てさまざまな生物種が今、存在します。それぞれの種にも多型が蓄積され、個体ごとの多様な違いも現れます。この多型を利用して品種改良を進めるのが、育種です。 多型がないと同じゲノム配列をもった個体ばかりが生まれ、育種はできません。地球上の多様な生命を理解するためにはさまざまな近交系を確立するだけでなく、雑種的な状態でもなるべく多くの自然界に存在する多型を保存していく努力も、しなければなりません。 こういったバイオリソースの開発整備によって生命の謎を解き明かすメンデルの大発見も可能となり、その発見から新しい知識を活用して育種ばかりでなく、病気の解明や地球自然の保護への発展ができるのです。生物多様性条約の必要性がいま世界的に叫ばれているのも、自然界の遺伝的多型をこれから人類が理解していく必要があるからに他なりません。
註:突然変異を誘発する化学物質。化学兵器として開発されたマスタードガスが化学変異原発見の最初の例と言われる。
( 新規変異マウス研究開発チーム 権藤洋一)
研究用のマウスとは
個体差をなくせる近交系
今週から4回にわたって、バイオリソースの一つである研究用のマウスを紹介します。
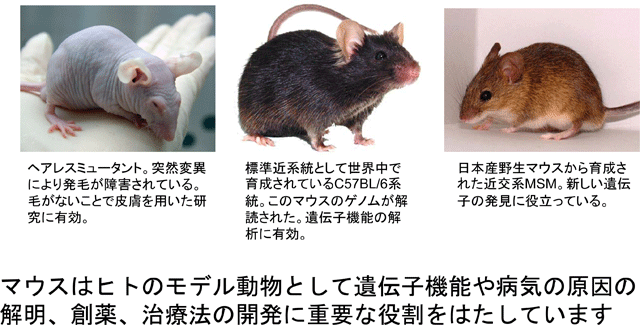
今日、世界中の研究者がヒトの遺伝子の働きを解明するためにしれつな競争をしています。その先には新薬や病気の治療法の開発があるからです。マウスはヒトのモデル動物として私たちの健康や病気の治療に役立ちます。マウスが多くの研究で役立つのには、理由があります。小型でよく増えること、ヒトと同じほ乳類で遺伝子がヒトとよく似ていること、そして個体差がほとんどなく、遺伝的にもほとんど同じ純系動物がであることが大きな理由です。
マウスの体重はおとなで20~30グラム、人の手のひらにおさまる大きさです。交尾後20日で5~10匹の子が生れ、子は生後6~8週でおとなになります。順調にいけば1年に4世代進みます。
遺伝学の研究では親の特徴が子に伝わるしくみを調べるため、短期間に子だくさんとなるマウスは格好のバイオリソースです。ヒトでは決してできない実験研究も、マウスであれば短期間で可能です。ヒトとマウスの遺伝子は90%以上が共通なため、マウスの研究はヒトにたいへん役立ちます。
今日の研究用のマウスの起源は1900年初めにさかのぼります。米国の遺伝学者キャッスル博士は欧米育ちのファンシーマウス(ペットのハツカネズミ)に中国や日本の珍しいマウスを交雑して、毛色や眼の色の遺伝の研究を行いました。その過程で、特徴的な毛色や眼の色を持った多数のミュータント系【注】が樹立されました。
キャッスル博士の弟子であるリトル博士は、これらのマウス系統でがんの研究を行い始めました。特定の系統ががんにかかりやすいことに気づき、がんの遺伝について研究を行い、遺伝的にほとんど同じマウスが必要であると考えて近親交配を繰り返し、近交系(純系)を育成しました。
マウスは1匹の母親が5~6匹の子を生みます。同腹の子からオスとメスを選び交配すること(兄妹交配)を20世代以上続けると、親兄弟姉妹どの個体をとっても遺伝的にほとんど同じになります。
こうして育成された近交系マウスの登場により、実験で大きな問題となる個体差を取り除くことに成功し、同じ実験処置を注意深く与えれば、ほぼ同じ実験結果が得られ、実験の精度が大きく向上しました。
100年以上の近交系マウスの育成過程で、がんや糖尿病、神経疾患などを特徴とする400種類以上の近交系が樹立され、今日の医療技術の発展や生命現象の解明を支えています。
【注】ミュータント系:遺伝的に変異した系統
( 実験動物開発室 吉木淳)
どんな種類がいるの?
私たちの遺伝子の働きや病気の治療法の研究に必要なマウスは、日々の研究現場で進化を続けています。人類が100年かけて育成してきた近交系マウスが近年、遺伝子組換え技術と出会い新しい遺伝子操作マウスが多数誕生しています。
理化学研究所バイオリソースセンター(BRC)が2001年に設立されて以来、我が国の重要なバイオリソースとして4700系統のマウスを収集・保存しており保有数は世界第2位です。これらの系統の70%近くは遺伝子操作によって生み出されたトランスジェニックとノックアウトマウスです。日本の研究者が長年努力して育成してきた近交系マウスやヒト疾患モデルとなるミュータント系も大切に保存されています。
トランスジェニックマウスは外来の遺伝子を受精卵に注入して作製します。BRCのトランスジェニックマウスの中でも最も多くの研究者に利用されているのはオワンクラゲの蛍光蛋白(GFP)遺伝子を全身で発現するグリーンマウスです。このマウスは大阪大学の岡部勝教授の開発したものですが、導入したGFP遺伝子に関しては米国の下村脩博士がその発光機構の解明で2008年のノーベル化学賞を受賞しています。BRCには特定の細胞が蛍光を発する200系統以上のマウスが保存され、解像度の高い蛍光顕微鏡と組み合わせてこれまで見ることのできなかった生命現象が解明されています。
ノックアウトマウスはもともとマウスが持っている特定の遺伝子の働きを失わせる方法です。こうすればマウスに病気や異常が現れてその遺伝子の役割が解明できるというアイデアです。ノックアウトマウスの作製にはES細胞(胚性幹細胞)の樹立と遺伝子ターゲティング法の確立が必要でした。2007年のノーベル医学・生理学賞はこのノックアウトマウスの作製法の確立に貢献したエバンス、カペッキ、スミシーズの3人の研究者が受賞しています。
バイオリソース(生物遺伝資源)とは医学・生物学、農学などの研究に必要な研究材料のことを指しますが、このバイオリソースは私たちの将来の研究と産業を発展させるために不可欠です。いちど作られた研究材料を大切に保存できれば未来の研究開発の種となり新しい発見や発明につながります。
天然資源の少ない日本にとって研究者の知的活動により生み出されたマウス系統も我が国の貴重な資源であり、国の資産です。生き物であるバイオリソースは一度絶えたら復元できないものとして特に大切な保存が求められています。
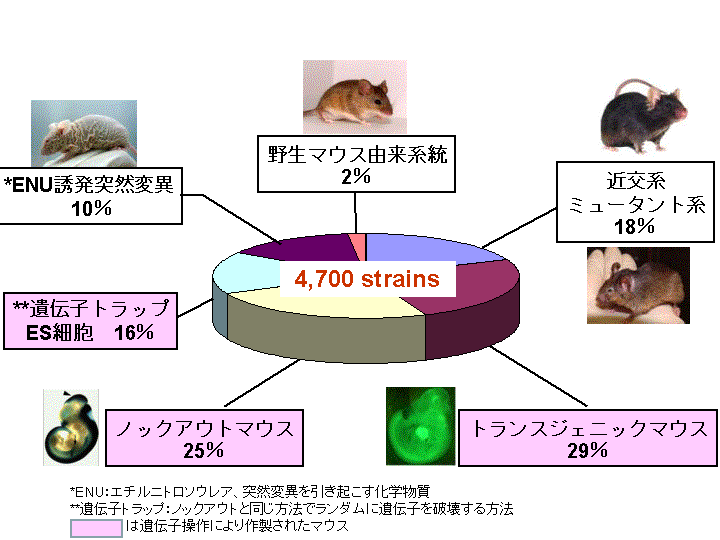
理研BRCの収集系統の種類
( 実験動物開発室 吉木淳)
感染症からまもる
マウスを研究のために飼育していく上で注意を払わなければならないことに、感染症対策があります。
もし細菌やウィルスによる感染症にかかったマウスを知らずに研究に利用してしまうと、研究結果が、実験の作用によるものか、感染の影響によるものかわからなくなり、間違った結論を出す恐れがあります。
また、マウスの系統の種類によっては免疫力が低く、細菌やウィルスに感染しやすいものもいますので、そのようなマウスが感染症にかかると死んでしまうこともあります。こうなると、研究自体もストップしてしまいますので、その被害は甚大です。
病気を引き起こす細菌やウィルスにマウスが感染していないかを確認する方法としては、主に二つの検査があります。1つ目は外部からマウスを導入する時の、入口での検査です。この時が一番、細菌やウィルスが持ち込まれる危険性が高くなります。そこで、まず入口で検査をして、感染の有無を確認します。空港で、国内に感染症を持ち込ませないようにしている検疫検査と同じで、いわば門番としての役割を果たしています。
一方、感染のないきれいなマウスを飼育室で飼っていても、モノやヒトなどから細菌やウィルスが持ち込まれる恐れがあります。そこで二つ目の検査として、すでに飼育室にいるマウスが感染症にかかっていないかを定期的に確認する検査を行います。広く利用されている方法としては、マウスの飼育ケージを収容している棚ごとに、囮(おとり)マウスと呼ばれる検査用のマウスを用意する方法があります。飼育ケージの床敷の交換の時に、使用済みの床敷を少量、囮マウスが入った飼育ケージに入れることで、飼育棚全体のマウスを囮マウスに間接的に接触させます。こうすることで、もし飼育中のマウスに感染症にかかったものがいれば、その飼育棚の囮マウスの検査で検出することができるのです。
また、マウスを細菌やウィルスの感染から守るためには、飼育室にもそれなりの工夫が必要です。私たちのセンターではマウスを感染のないきれいな状態で飼育するために、マウスの生活や繁殖に適した温度湿度条件になっているだけでなく、高性能フィルターでろ過したきれいな空気が供給され、外部から汚れた空気が流れ込まないような仕組みになっています。中に入れる飼育ケージや餌も、全て滅菌されたものを使用し、飼育室で作業する人も半導体工場や食品工場で働く人のように、シャワーを浴び、滅菌した作業服を着て中に入ります。
飼育室内では常にマウスの健康状態に気を配り、きれいな状態で飼育できるよう環境維持に努めています。

図1:病気の有無をチェックする診断キット。特定の細菌やウィルスに感染していると変色する。

図2:マウス飼育室での作業の様子。作業者は滅菌された作業服を着用して作業を行う。前面に色付きのカードが付いているのが飼育ケージ。
(実験動物開発室 目加田和之)
遺伝背景を統御する
研究に利用されるマウスは、実験の結果や精度の信頼性を高めるために、個体差の少ない遺伝的に均一な状態であることが重要です。
遺伝的な均一性を高めたマウスを近交系と呼ぶのですが、現在では、糖尿病や癌、神経疾患などを特徴とするさまざまな系統が育成されています。これらは、それぞれ特異的な遺伝情報(遺伝背景)をもっており、各近交系の特徴を決める大きな要因になっています。
そのため、いったん別の系統と混ざってしまうと、目的の症状を示さなくなってしまう恐れがあります。さらに、遺伝的な均一性も崩れてしまいますので、実験の精度が落ちてしまいます。
一方、マウスは見た目の違いが小さく、同じ毛色のマウスであれば系統が違っていても区別することは難しく、系統の取り違えや、不慮の交配などにより別の系統が混ざってしまった場合、なかなか気付くことができません。そこで、マウスの維持に際しては、目的の遺伝背景をもっているかどうかを定期的に検査することで、系統の遺伝的品質が保たれているか確認します。
現在、広く利用されている検査法としてはDNA配列を調べる方法があります。マウスのDNAの配列には多型が存在している場所が多く知られています。系統によって配列が異なっている部分を検査することで、そのマウスがどの系統であるのかを判断することができます。もし、別の系統であったり、別の系統と混ざったマウスであれば、異なった配列になりますので簡単に区別することができます。これは、ヒトの親子の血縁鑑定や、犯罪捜査に利用されているDNA鑑定と同じ手法です。
マウスの場合、この遺伝背景の検査法は新しい系統の育成にも利用されています。変異を持った遺伝子の表現型は、しばしば遺伝背景により変わってくることが知られています。そこで、変異遺伝子をもつマウスを異なる遺伝背景の近交系マウスに繰り返して交配(戻し交配と呼びます)することで、別の遺伝背景に置き換えたマウスを育成することがあります。
通常、10~12回の戻し交配が必要とされ、育成までに3~5年かかっていたのですが、毎世代ごとにDNA配列を調べ、より目的の遺伝背景に置き換わったマウスを選別することで、短期間(1~3年)で新しい系統を育成することが可能です。
マウスの遺伝背景を統御することは、貴重なマウス系統の確実な保存や、新しい系統の育成に欠かせません。
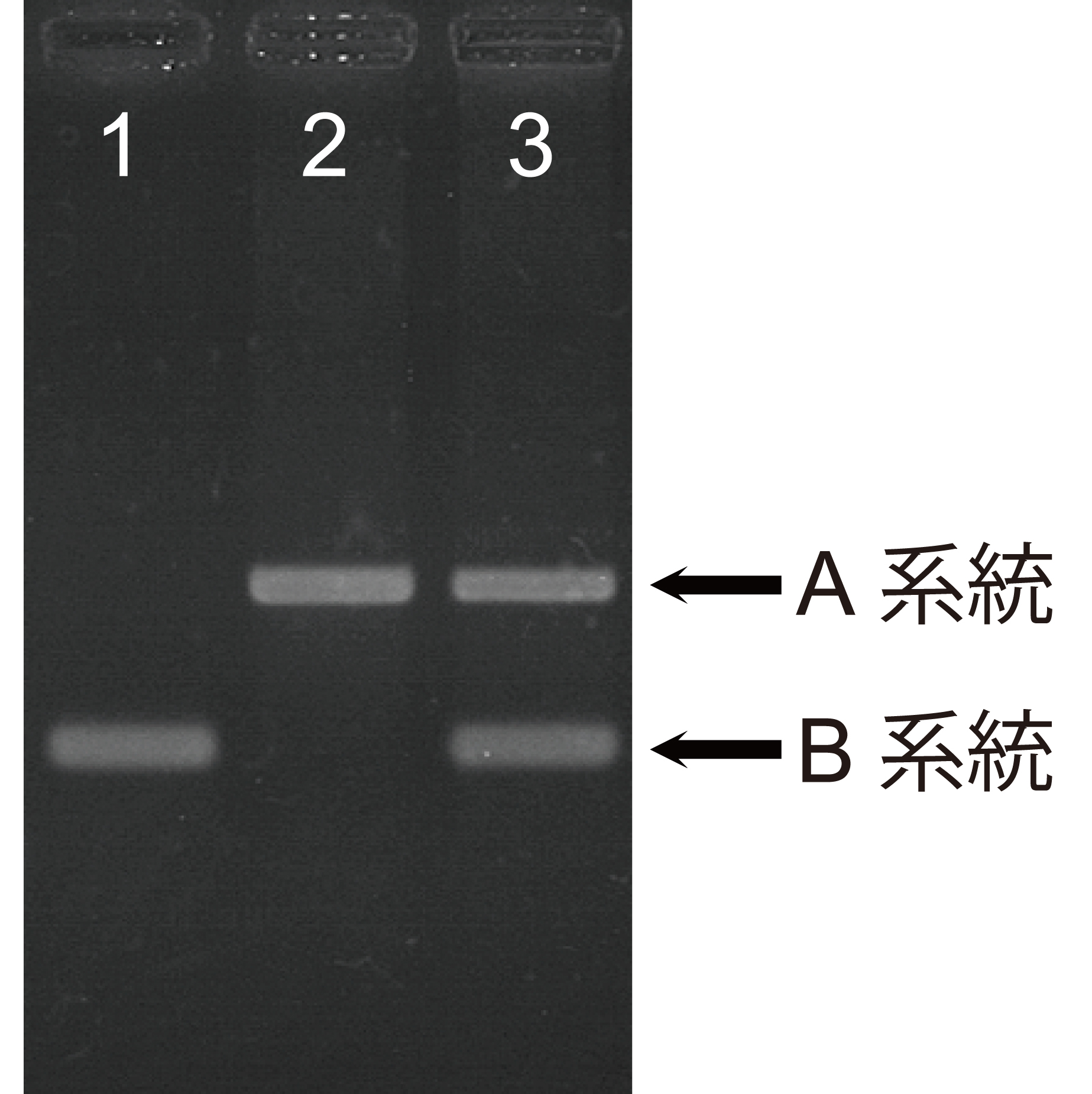
【図の説明】遺伝背景検査。系統ごとのDNAの配列の違いをバンドの違いで確認できる。1と2のマウスは異なる遺伝背景、3のマウスはAとBの交雑であることがわかる。
(実験動物開発室 目加田和之)
実験植物
実験室に最適、シロイヌナズナ
皆様はシロイヌナズナという植物をご存知でしょうか?
シロイヌナズナはアブラナ科植物の仲間でユーラシア大陸に広く自生していますが、産業的な価値がない雑草です。ところが発芽直後は数ミリ程度しかないこの小さな植物が、最先端の研究では今やスーパーモデル並みの活躍をしています。これからの4回は、シロイヌナズナを中心に植物の話題を紹介したいと思います。
植物は人間の生存に欠かせない食料や酸素、材木や医薬品を供給する重要なパートナーです。でもシロイヌナズナは食料にも有用物質の生産にも向いていません。それではなぜこの植物が研究に使われるのでしょうか?その理由はシロイヌナズナの体そのものにあります。
植物のゲノムや遺伝子の働きを研究するには、実験材料となる植物を環境の整った室内で育てる必要があります。この植物の小さな体は、まさに実験室向きと言えましょう。サイズに加え、研究社会で標準の株として使われているシロイヌナズナは蛍光灯の下でも育ち3カ月程度で種子が実るなど、室内で取り扱う上で多くの利点を持っています。
しかしいくら使いやすいとはいえ、どうしてこれを選ぶのかまだ納得いかない方もいらっしゃると思います。実際には、作物などの実用植物を使いたい研究者も数多くいます。私自身もかつてイネを使った研究を進めていましたが、途中から材料をシロイヌナズナに変えています。
その理由は、研究に役立つ多種多様なリソース(実験材料)と豊富な技術、情報がシロイヌナズナにはそろっているためです。有用な植物はイネ以外にも限りなく存在します。そのすべてについてリソースや情報をあらかじめそろえておくことは不可能です。そこで研究者たちは扱いやすいシロイヌナズナを植物の代表(モデル)として選び、リソース、情報を網羅的に整備するとともに、さまざまな解析技術も開発してきました。
ちなみにシロイヌナズナは体のサイズだけでなくゲノムの大きさも際立って小さかったため、高等植物の中で最初に全ゲノムの解読が終了しています。
バイオリソースセンターでは、このシロイヌナズナのリソースや情報を研究者に提供する仕事をしています。
それではシロイヌナズナのリソースや情報を土台としてどのような研究が進められているか、次回以降にその例をご紹介したいと思います。

図)さまざまな研究に利用されているシロイヌナズナ
(実験植物開発室 小林正智)
酸性土でもよく育つ植物
前回はシロイヌナズナに研究上のさまざまなメリットがあることをお話しました。今回はこの植物を使った研究の一例を紹介します。
近年、世界各地で農地の酸性化が問題になっています。酸性化すると農作物の生育が悪くなり、収穫量が低下します。畑に石灰の白い粉を散布しているところを見た方もいると思いますが、石灰を散布することで一時的に土を中和することができます。しかし費用がかさむことから、貧しい国々では土の酸性化は大きな問題です。
なぜ土が酸性化すると植物が育たなくなるのかについては、実はよくわかっていません。そこで私たちは酸性環境で生育が悪くなりやすいシロイヌナズナの変異体(ミュータント)を探し出し、なぜ生育が悪くなったのかを調べました。少し専門的になりますが、今回使った変異体についてお話しましょう。
シロイヌナズナに特殊な薬剤をかけると、一定の確率でDNAに変異(変化)がおこります。そしてたまたま大切な遺伝子に変異がおきた場合、その遺伝子の機能が変化したり失われたりするため、もとの植物と少しだけ違った植物になります。このようにしてつくったいろいろな変異体は世界中でさまざまな研究に使われています。
話を私たちの研究に戻しましょう。約2万5000株の変異体を酸性環境で生育させたところ、もとの植物に比べ根が著しく短くなる植物を一つ見つけることができました。酸性が弱いと正常に育つので、この変異体は酸性下で成長するために必要な遺伝子が変化した可能性があります。
そこでこの変異体を調べた結果、他の遺伝子の機能を入れたり切ったりすることのできるスイッチの働きをするたんぱく質(転写制御因子)の遺伝子に異常が発見されました。シロイヌナズナは2500以上の転写制御因子を持ち、2万7000の遺伝子の機能を制御しています。今回発見した変異体では2500のうちのわずかひとつの転写制御因子に異常が生じただけで、酸性下で正常に育つことができなくなりました。つまり、この転写制御因子は植物が酸性の環境に適応するうえでカギの役割をしていると考えられます。
今私たちは、この転写制御因子の役割を詳しく調べています。将来、この転写制御因子の機能を活用して酸性土でもすくすく育つ樹木や作物が開発されるかもしれません。
このように、シロイヌナズナの変異体は研究に役立つ大事なリソースです。当センターではさまざまな変異体のリソースを内外の研究者に配布しており、多くの有用な遺伝子が見つかることが期待されています。
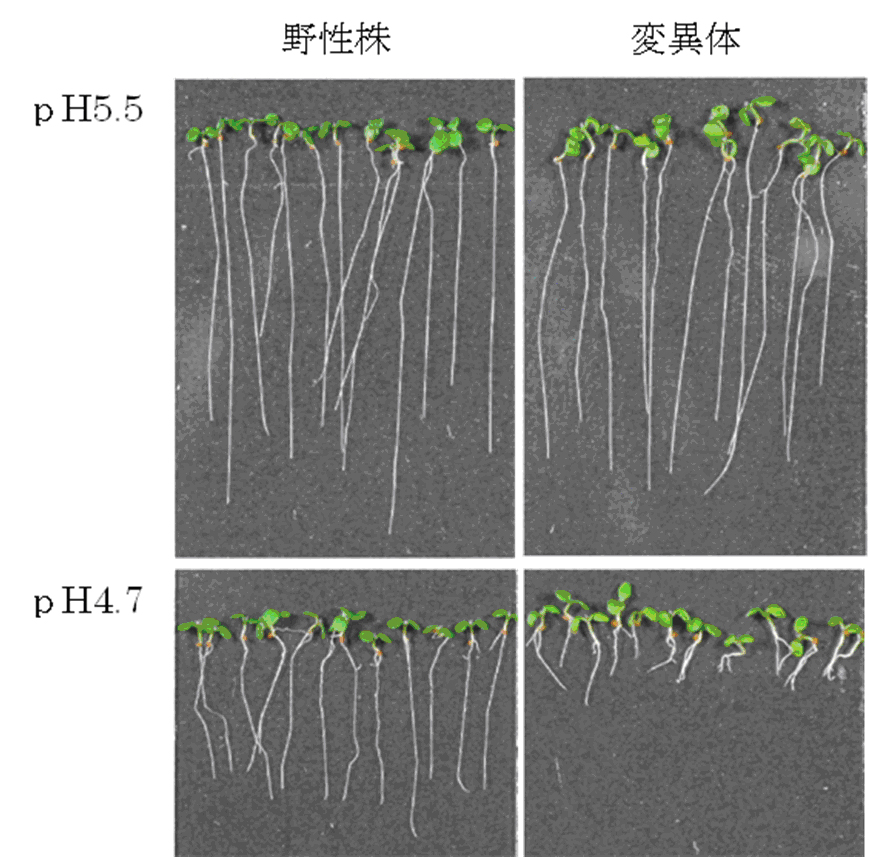
図)シロイヌナズナ変異株の酸高感受性(右下)
(実験植物開発室 井内 聖)
シロイヌナズナの成果を白菜に
観測史上初という文字が踊った猛暑の夏も過ぎ、朝晩の冷え込みを感じるようになりました。スーパーでは冬野菜の代表格である白菜が目を引く季節です。茨城県は白菜産地として知られ、その生産高は長野県と日本一を争っています。
皆さんは白菜がどのようにして誕生したのかご存じでしょうか?また、日本人はいつごろから白菜を食べ始めたのかご存じですか?白菜はカブとチンゲンザイを交雑することで誕生したと考えられています。そして意外なことですが、白菜は明治以降に中国から日本に入ってきたようです。当初、日本での白菜栽培は困難を極めましたが、茨城県では安定した栽培に向けた試みが積極的になされ、白菜産地としての地位を確立してきました。
このように茨城と縁の深い白菜ですが、植物研究の分野では現在、世界的に注目が高まっており、日本を含む世界各国で協調して進めていた白菜のゲノム配列決定プロジェクトも終了間近です。なぜ今、白菜なのでしょうか?
実は白菜がアブラナ科作物であることと深く関連しています。現在、もっとも研究が進んでいる植物はアブラナ科の雑草であるシロイヌナズナです。これまでにシロイヌナズナでは、花の形成、葉の形、病原菌や害虫に対する抵抗性、さまざまな環境変化に対する適応力を調節しているなど、数多くの遺伝子が明らかになっています。また、これら遺伝子の機能を利用することで、病害虫抵抗性を強化したり、環境変化に対する適応力を強くしたりできるようになっています。
シロイヌナズナで可能となったこれらの技術を、実際に食べることができる農作物に役立てようという試みが現在、世界的に始まっています。その際にシロイヌナズナと近縁な白菜が、格好の材料と考えられているわけです。
当センターではこのような状況を予想して、これまでに数多くの有用な白菜遺伝子を取得し、その塩基配列を決定してきました。また、これら遺伝子はどのような状況で働いているのか調べています。これまでに整備した白菜遺伝子や、その情報は、これから本格的に植物研究者に提供を開始する予定で、期待が高まっています。
シロイヌナズナで得られた知見が白菜で実を結び、「栽培しやすい」「病害虫に強い」「健康に良い」などのスーパー白菜が登場する日も、そう遠くないかもしれません。
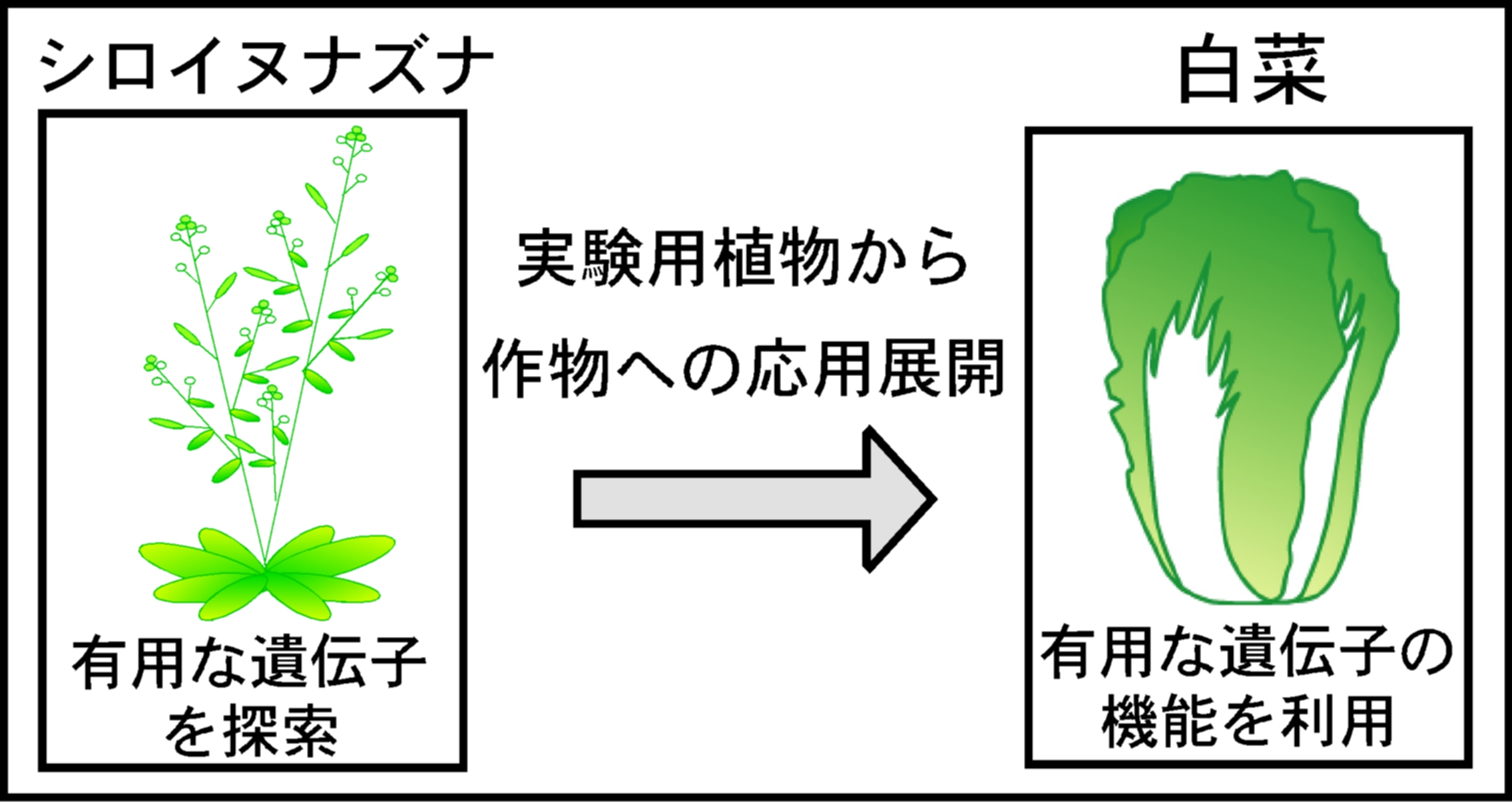
図)シロイヌナズナで見いだした成果が農作物の改良に役立てられ始めています
(実験植物開発室 安部 洋)
植物培養細胞とは
まず、写真を見てください。フラスコの中に見えるものは何でしょうか?これは植物細胞のかたまりで、植物培養細胞といいます。
植物はたくさんの細胞からできています。葉や根の一部を切り取って植物ホルモンや栄養分の入ったかんてん培地の上に置いておくと、その中の細胞が増殖をはじめます。やがて葉や根のような植物の形を失い、無限に増えつづける細胞のかたまり、培養細胞になります。この培養細胞は植物の形をしていませんが、普通の植物と同じように生命活動をしています。
植物培養細胞には、研究に適した特徴があります。まず、培養細胞は普通の植物体よりも速く増えます。次に、植物体は葉や根のようにいろいろな種類の細胞からできているのに対し、培養細胞は同じ性質を持つ均質な細胞からできています。さらに、フラスコなど容器の中で育てているので、簡単に生育条件を整えることができます。これらの長所を持つ培養細胞は基礎研究から応用研究まで幅広く利用されています。
例えば、植物培養細胞を用いて物質生産を目指した研究が行われています。植物は薬や香料・色素・樹脂などとして役に立つ多くの物質を作ります。しかし、普通の植物体では有用物質を作る組織が限られていたり、量が少なかったりします。そこで、増殖が速く均質な培養細胞の特徴を生かして、有用物質を大量生産する研究が進められてきました。
バイオリソースセンターにも赤い色素を作るブドウやヨウシュヤマゴボウの培養細胞があります。これらは日本の研究者が長年研究を積み重ねて苦労して作りあげた貴重なバイオリソースです。
私たちはモデル植物シロイヌナズナの培養細胞をはじめ、いろいろな植物の培養細胞を保存しています。しかし、種子のように何もせずに保存しておくことができないため、その維持はとても大変です。培養細胞はかんてん培地上で維持していますが、どんどん増えつづけますので、定期的に培養細胞の一部分を切り取って新しい培地に植えかえる作業が必要です。
そこで、私達は培養細胞を凍結して保存する技術開発を行っています。この技術を完成させて、大切な植物培養細胞を安全に保存し、植物科学研究の推進に貢献することがバイオリソースセンターの役割なのです。

写真)ヨウシュヤマゴボウの植物培養細胞。赤い色素を作る。三角フラスコ中のかんてん培地の上で育っている
(実験植物開発室 小林俊弘)
細胞リソース
画期的な「がん細胞株」樹立
今週から4回にわたって、バイオリソースの一つである研究用の細胞について紹介します。
生物の最小単位は細胞です。私たちの身体は約60~100兆個の細胞からできていると考えられています。これらの細胞は性質の異なるグループに分けることができます。例えば皮膚の細胞、脳の細胞、心臓の細胞、肝臓の細胞などなどです。実は、皮膚の細胞や脳の細胞は、その中でもっと細かく分類されるのですが、ここでは触れません。
個々の細胞の正常な機能を知るためには、またアトピー性皮膚炎やアルツハイマー病といった病気の研究を行うためには、こうした細胞が研究材料として必要不可欠です。ただ、ヒトの細胞はそれほど簡単には入手できませんので、実験モデル動物(サルやネズミなど)の細胞も基礎研究にたくさん使われています。そして、人類の福祉向上に多大な貢献をしています。しかしながら、病気の原因の最終的な究明や治療薬の開発といった分野では、ヒトの細胞を使った研究が重要となります。
幸いなことに多くの細胞に関して、試験管の中で培養をして増やす技術が開発されています。試験管の中で増やすことができれば、細胞を繰り返して使うことや、より多くの研究に使うことが可能となります。
細胞の培養が始まったのは1907年と言われていますが、その後さまざまな技術の開発によって、細胞培養は飛躍的な発展を遂げています。そんな中で「がん細胞株」の樹立は画期的でした。ヒトの正常な細胞は短期間は培養できますが、せいぜい数カ月です。それ以上は増やすことができません。ところが、がん細胞から半永久的に試験管の中で増え続ける細胞を作ることができる、ということが分かりました。1952年のことでした。その後、さまざまな「がん細胞株」が樹立され、このバイオリソースはがん研究のみならず、多くの生命科学研究に非常に大きな貢献をしてきました。
細胞材料には、細胞そのものの特性を研究すること以外に、もう一つ別な利用法があります。それは、細胞内の遺伝子情報を解析することです。
遺伝子を解析する技術は急速に発展しています。近いうちに、簡単に個々人の全遺伝子情報が解析できる時代が必ず到来します。その際には、これまでに保存されてきた培養細胞も、大変有意義な研究材料となります。次回はその一例を紹介する予定です。
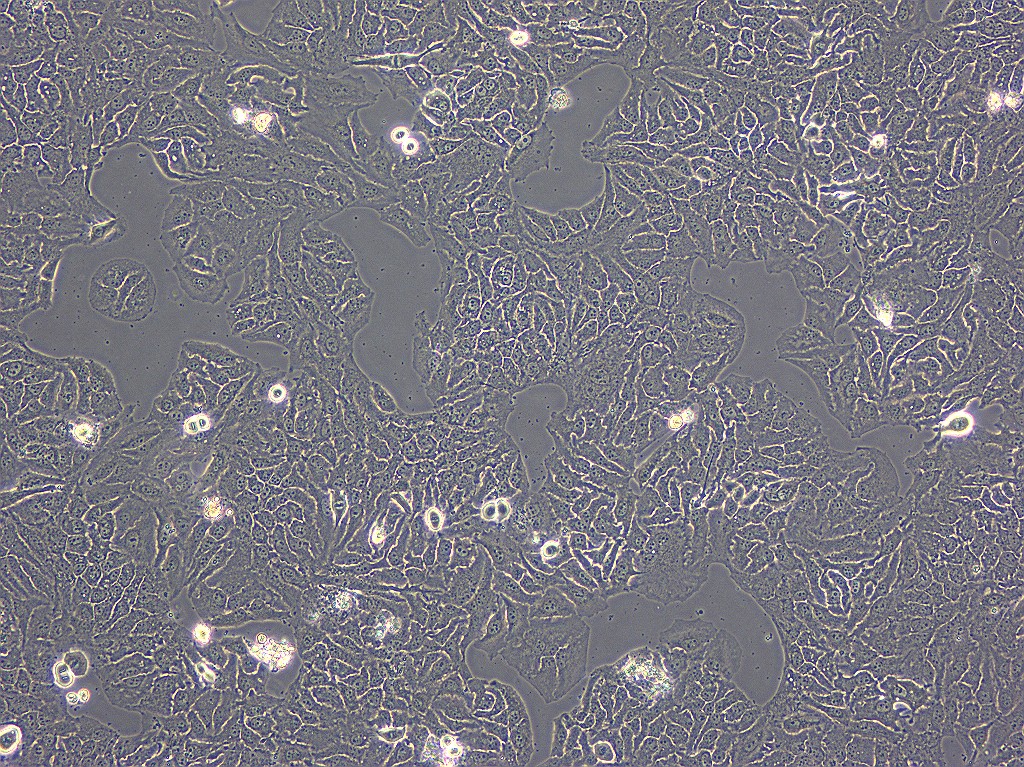
写真) 世界で初めて樹立された「がん細胞株(HeLa細胞)」
(細胞材料開発室 中村幸夫)
人類の大陸移動
今回は遺伝情報の解析に利用される培養細胞について解説します。
遺伝情報の解析には正常なゲノム(※1)構造の細胞株が必要で、代表例としてB細胞株が挙げられます。B細胞株は、血液中のBリンパ球(※2)に特殊なウイルスを感染させてつくります。では、遺伝情報を解析するとどんなことが分かるのでしょうか?
遺伝情報を解析すると、個人差や、人種、民族の違いを調べることができます。個人差を調べる研究はオーダーメード医療(※3)などに直結しています。人種や民族の違いを調べる人類遺伝学研究により、有史以前から続く人類の歴史を解き明かす手がかりが得られます。その人類遺伝学研究の一例をご紹介しましょう。
ヒトの祖先は600万年前にアフリカで誕生したと考えられています。我々の直接の祖先は約9万年前にアフリカを出発し、5万年をかけてユーラシア大陸全土とオセアニアに、約1万年前には南米大陸に到達しました。アフリカを出てから8万年、人類はどのような経路で世界中に広がったのでしょうか?
記録は残っておらず、もちろん飛行機や鉄道もありません。人類遺伝学の研究者は、遺伝情報を解析することで、その道筋をたどろうと考えました。
時間の経過とともにヒトのゲノムは少しずつ変化します。人種や民族の遺伝情報を比較し、違いが大きければ道がわかれてから長い時間が経過し、小さければ比較的最近(数千年単位で)部族が分かれたと判定します。この作業をつみかさねて、少しずつ移動経路を明らかにしていくのです。
解析を行うためには純粋な部族の人たちの細胞材料が必要ですが、彼らの居住地は、多くが交通の便が非常に悪い辺境の地です。
園田俊郎鹿児島大学名誉教授のグループはそういった集落を訪ね、30年近い歳月をかけて世界中の純粋な部族の血液検体を集めました(図参照)。これだけ多くの純粋部族のコレクションは世界的にも例がなく、「人類遺産」というにふさわしいものです。園田教授の退官時に、その貴重なバイオリソースは理研バイオリソースセンターに譲渡されました。
血液検体は量が限られており、研究に使用するとすぐになくなってしまいます。当センターはこの血液検体からB細胞株を樹立して、無限に増殖する細胞株をつくりつつ人類遺伝学研究を進めています。
「地球の歴史は地層に刻まれ、生物の歴史は染色体(ゲノム)に刻まれる」とは木原均(※4)の言葉です。
※1: ゲノム:染色体にふくまれるDNA 全体のこと ※2: Bリンパ球:白血球の一種 ※3: オーダーメード医療:同じ病気であっても個々人で薬の効き方や治療法が異なる。個々人の個性に応じた治療を行うこと。 ※4: 木原均(きはらひとし・1893~1986):日本の遺伝学者。ゲノムの遷移や進化の過程を調査する手法を確立した。
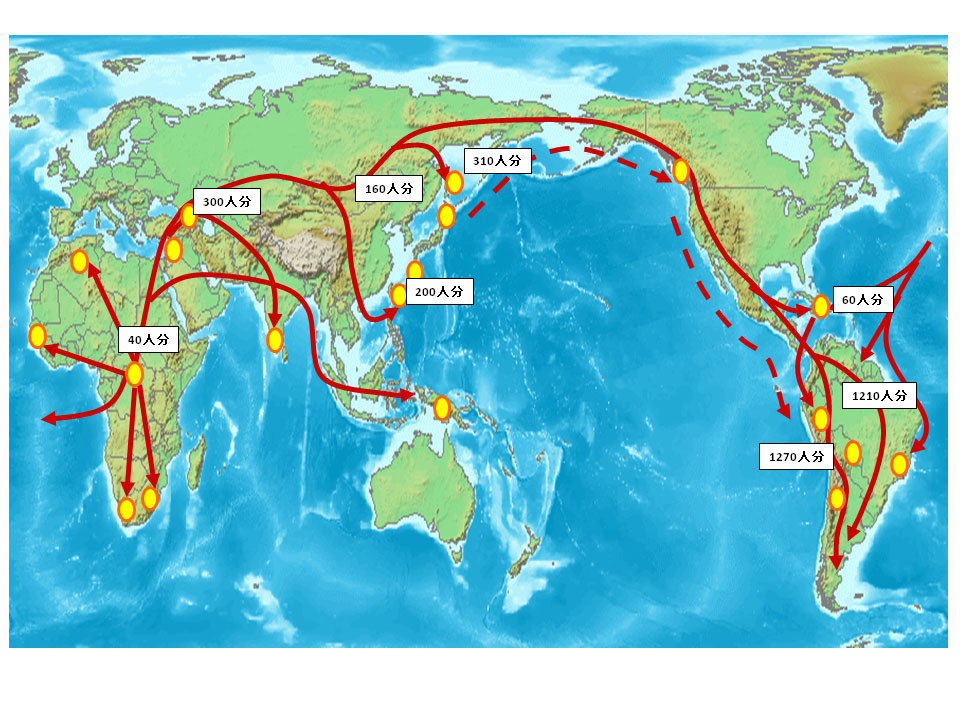
図)多くの研究者に受け入れられている人類の移動経路と、園田・田島コレクション検体の採取地域および検体数。赤い矢印はアフリカを出発してからの人類の移動の軌跡を表し、黄色い点は血液検体を採取した主な地域を表している。四角の数字は採取検体数。
(細胞材料開発室 檀上稲穂)
万能細胞とは
前々回は「がん細胞株」などの培養細胞の有用性について、前回は遺伝子解析研究の材料としての培養細胞の有用性について紹介しました。今回は、培養細胞から特殊な細胞を作るお話をします。
私たちの身体は約60~100兆個の細胞からできていることを紹介しました。しかし、一度できた細胞が一生にわたって使われ続けるわけではありません。例えば、お風呂に入って皮ふをこするとアカが出ますが、これは古くなった皮ふ細胞の残がいで、毎日新しい皮ふ細胞が作られています。胃腸のねん膜も、血液も、毎日新しい細胞が作られ、古くなった細胞は除かれています。このように、私たちの身体は、いつも細胞の置きかえが起こっており、新しい細胞を作り出すもとになる細胞を幹(かん)細胞といいます。
たとえば皮ふという組織には、皮ふに固有の幹細胞から機能細胞(分化細胞)が作られます。もし、この幹細胞を培養して増やすことができれば、そこから特殊な機能細胞をたくさん作ることができ大変有用なのですが、人工的に効率よく培養できる幹細胞はとても少ないのが現状です。今後の技術に進歩により、今よりももっと多くの幹細胞が培養できるようになると期待されています。
私たちの身体の中で日々新しい細胞を作り出している幹細胞は、専門用語では体性幹細胞といいますが、すべての体性幹細胞は、元々受精卵という1個の細胞から生まれてきた細胞です。受精卵が数回から数十回増殖(細胞分れつ)した細胞の集団を胚細胞といいますが、この胚細胞のうち試験管の中で半永久的に培養できるようになった細胞を胚性幹細胞(ES細胞)といいます。
ヒトの胚性幹細胞は1998年に樹立されました。そして、胚性幹細胞からはありとあらゆる細胞を試験管の中で作り出すことができるのです。しかし、胚細胞を入手することは簡単ではありませんし、人間になり得る胚細胞を使うということで、倫理的な問題も含んでいます。
2006年、日本の研究者(京都大学山中伸弥教授)が歴史的な大発見をしました。皮ふの細胞の中で4種類のたんぱく質を大量に生産すると、皮ふの細胞が胚性幹細胞のような細胞に変化したのです。この細胞は人工多能性幹細胞(iPS細胞)と名付けました。そして、翌年にはヒトiPS細胞の作製にも成功しました。iPS細胞はとても簡単に作製でき、胚性幹細胞とまったく同じように、ありとあらゆる細胞を試験管の中でiPS細胞から作り出すことができます。そのためiPS細胞は万能細胞とも呼ばれており、将来再生医療の発展により、わたしたちの健康にとても関わりを持つようになることでしょう。
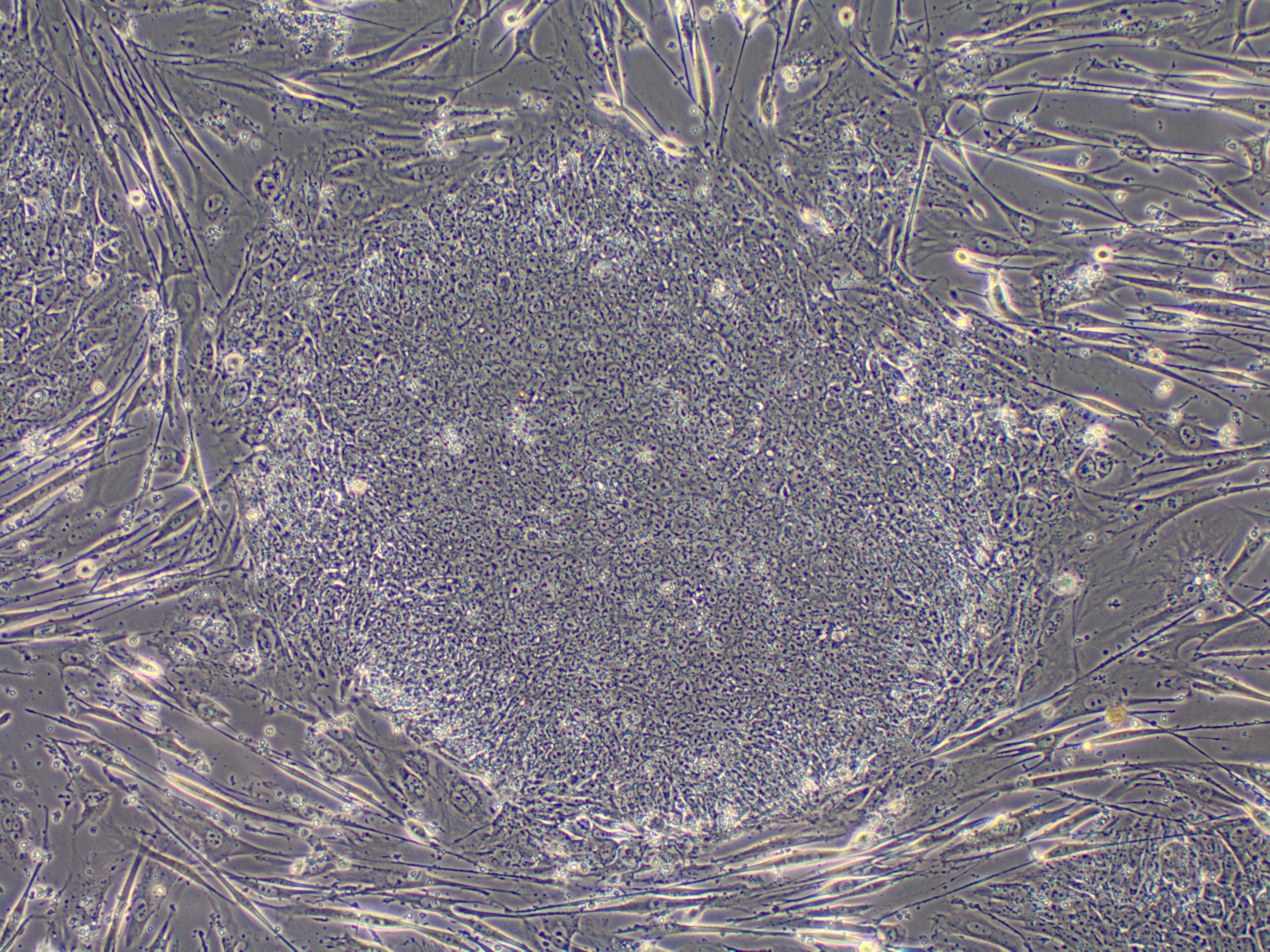
写真) ヒトiPS細胞。丸く見えるのがiPS細胞の集団(コロニーという)
(細胞材料開発室 中村幸夫)
輸血に使える赤血球をつくる
ケガ、手術などでの大量出血や病気の治療のために輸血という方法があるのはみなさんよく知っていると思います。
輸血で使われる血液は健康な人の善意による献血によって集められています。今のところすぐに輸血用の血液が足りなくなるということは無いようですが、最近は献血をする人の数が減ってきているそうです。これから先、少子高齢化が進むにつれ、このまま献血をする人が減ってしまうと、将来輸血に使える血液が足りなくなることが心配されています。
また、献血をする時にはエイズや肝炎など血液から感染する病気の検査をしますが、感染したばかりの人は検査をしても発見できなかったり、今までに知られていない病気は見つけられないという問題があります。このような問題を解決できる可能性が「万能細胞」には秘められているのです。
万能細胞は体のどんな部分の細胞にもなることができる細胞であることは前回紹介しましたが、私たちは万能細胞から輸血に必要な赤血球の“素”になる細胞をつくる研究をしています。万能細胞から赤血球をつくるにはある特定のタンパク質を万能細胞に加えて培養することで、つくることができます。
しかしながら赤血球だけをつくることは難しく、白血球など他の血液細胞も同時にできてしまいます。白血球は輸血したときに拒絶・炎症などを起こす原因になるので無いほうがいいのです。また、できた赤血球は増やすことができないので、常に万能細胞からつくり続けなければなりません。これでは大量につくるためには時間と労力に加えお金もかかりすぎます。
そこで、私たちは赤血球にしかならない赤血球の“素”になる細胞(赤血球前駆細胞)をマウスの胚性幹細胞(ES細胞)からつくりました。この細胞は万能細胞のように増えることができるのですが、万能細胞とは違って赤血球だけをつくり出すことができます。
また万能細胞から赤血球をつくるには2週間程度かかりますが、この赤血球前駆細胞からは3?4日でつくることができます。つまり赤血球前駆細胞を使えば、1)赤血球のみを、2)短期間で、3)大量につくることが可能になるのです。
現在、私たちはヒト万能細胞から赤血球前駆細胞をつくるために研究を進めています。将来、献血に頼らない輸血医療の確立を目指して!
でも、みなさん、献血へのご協力はお忘れなく・・・。
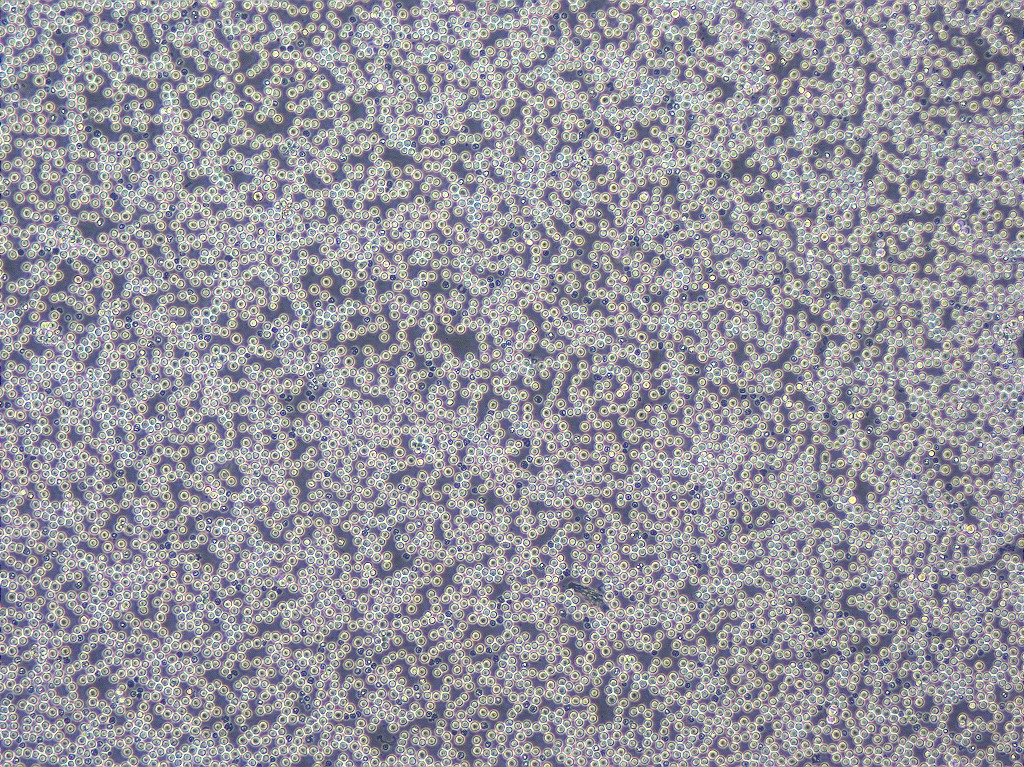
写真)赤血球前駆細胞

写真) 赤血球へ変化後
(細胞材料開発室 寛山 隆)
微生物リソース
健康と環境に役立つ微生物
微生物というと、不潔なバイキンや病気を引き起こす悪者を連想される方が多いかもしれません。
微生物はとても小さい生物で肉眼では見えませんが、実は地球上に最も種類が多く、最も生存量の大きい生物です。そしてそこら中にいて、時に人の役に立ったり、地球の環境を支える大切な役割をしています。 例えば、微生物が作りだすさまざまな物質は、
- 病気の原因となる微生物をやっつける抗生物質や
- 微生物とは直接関係ない病気の治療薬など、
いろいろな目的の医薬品として利用されています。
みそやしょうゆ、納豆、かつお節、漬け物、ヨーグルトなど、毎日口にする食品も、微生物の働きで作り出されているものがたくさんあります。ふわふわした柔らかいパンも、イースト菌(酵母)がないとつくれません。
実は皆さんの腸の中や皮膚にはたくさんの微生物がいて、栄養や健康増進に大事な役割を果たしています。健康な人にいる微生物は、病気を引き起こす微生物の侵入を防ぐとも言われています。ヨーグルトに含まれる乳酸菌は、便秘の改善などの整腸作用や、アレルギーの改善など免疫のバランスを整える働きがあるとされています。
微生物は、地球上のいたる所でさまざまな物質を分解したり、変換することによって生きています。動物の遺体や植物の枯れ葉や倒木が土にかえるのも、微生物の働きによります。こうした微生物の活動の結果、地球上の物質循環が成立しています。温暖化やエネルギーなど環境への問題意識が高まっている今、地球環境を支える微生物の働きに注目する必要があります。
環境にやさしい製品や技術にも、微生物が利用されています。容易に分解されて土にかえるプラスチックの生産も、微生物が作り出した物質が利用されています。生活排水をきれいにしてくれる浄化施設でも、微生物が働いてくれています。
植物の根やその周辺にはたくさんの微生物がいて、植物の栄養や生育に大切な役割をするなど、農作物の増産のためにも微生物の重要性は高まっています。
このように人の生活や健康、環境と微生物は、大変密接な関係にあります。微生物のことをよく知って、微生物と共に上手に暮らし、その能力を最大限に利用していくことは、ますます重要になってきています。 当センターでは、さまざまな能力を持った多種多様な微生物リソースを整備して、微生物を理解する研究や利用するための研究に役立てていただいています。
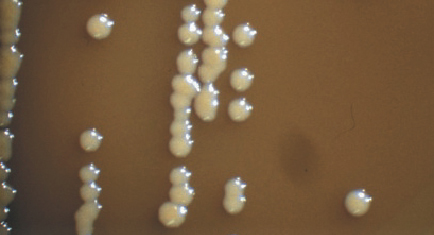
写真)Lactobacillus属乳酸菌が寒天培地上に作ったコロニー
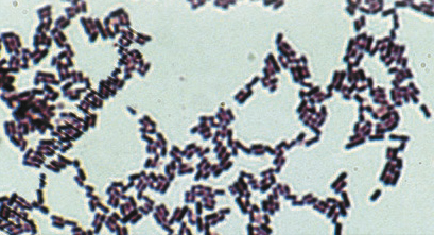
写真) 細胞染色後の顕微鏡観察像
(微生物材料開発室 大熊盛也)
凍結・融解
命を復活させる技術
年末に家の冷凍庫を大掃除していたところ、いつのものかわからない化石のようになった牛肉を見つけました。たいていの食品には賞味期限や消費期限があります。肉や魚などであれば冷蔵で数週間、冷凍でも数カ月が「食品」としての限界でしょう。当然、その「化石」は食べることをあきらめざるを得ませんでした。
理研バイオリソースセンター(BRC)ではさまざまな生物資源を収集・保存・提供していますが、そのすべてを生きたまま保存しようとすれば、維持にかかる場所や費用は膨大なものとなります。そのため、例えばマウスであれば一部は精子や卵子、および受精卵としてマイナス196度の液体窒素で凍結させることにより、貴重な「種」を効率的かつ半永久的に保存することが可能となります。
マイナス196度で凍らせた精子や卵子も融解して受精させれば、新しい命として誕生してくるわけですが、正常な命としてより効果的に復活させるためには、その凍結・融解技術をさらに高める必要があります。
家庭用冷凍庫で凍らせた食品の消費期限がせいぜい数カ月程度だとすれば、同様に家庭用冷凍庫で凍らせたマウスを新しい命として復活させるための期限は、どのくらいなのでしょうか?
これまでに私たちは、15年間も家庭用冷凍庫と同じ温度(マイナス20度)で凍らせたままだったマウスから採取した精子を、卵子に注入(顕微授精)して子供を得ることに成功しています(写真)。
しかし、そもそも精子や卵子ができないようなマウスだったとしたら、そこからどのようにして命をつむげば良いのでしょうか?その場合、クローン技術を用いればその命を復活させることができます。精子や卵子ができないマウスの皮膚細胞(体細胞)から核だけを取り出し、あらかじめ核を除いた正常なマウスの卵子に皮膚細胞から取り出した核を入れて刺激を与えれば、もともと皮膚としての記憶に従っていた核が受精卵としての記憶を思い出し、新しい命として復活するのです。
このように命をつなぐ技術を極め続けていくことにより、どのような状態の生物資源(バイオリソース)からでも、そこから命として復活させて種を維持することが可能となります。もしかしたら将来、永久凍土で凍っているマンモスの命も復活させることができるようになるかもしれません。

図)15年間凍っていた体から採取した精子で復活したマウス
(遺伝工学基盤技術室 本多 新)
変異マウス開発
突然変異体って何?
突然変異体(ミュータント)とはなんでしょうか?
例えば白いヘビは、色素を作る遺伝子に突然変異が起こり、色素が作れなくなった突然変異体です。生物は、たまたま起こった突然変異が生存に有益な時、その形質を持った個体が生き残り、さまざまな進化を遂げてきました。しかし、生物にとって有益な突然変異は極めてまれであり、病気になってしまう有害な突然変異や全く影響を及ぼさない突然変異がほとんどです。
さて、突然変異とはそもそも何でしょう?地球上のすべての生物は、生命の設計図としてゲノムを持っています。ゲノムはDNAの配列からできており、DNAは4種類の塩基(G、A、T、C)があります。この4種類の塩基の配列の組み合わせがタンパク質の設計図(遺伝子)となります。ヒトやマウスのゲノムは約30億の塩基からなり、この一部(1~2%)に3万種類弱の遺伝子が暗号化されています。突然変異とは、このゲノムのDNA配列に生じた変化を指します。
理研バイオリソースセンターでは1万系統ものENU(※1)変異マウスをバイオリソースのひとつとして公開しています。それぞれのマウスのゲノムにはENUによって誘発された点突然変異(※2)がたくさん生じています。私たちの解析から、1系統のマウスのゲノムには約3000カ所にランダムな点突然変異があることがわかりました。ですから、1万系統全体では1万×3000=3千万となり、約3千万個の点突然変異がゲノムに蓄積されていることになります。
そのため、遺伝子の長さの平均が1000塩基~2000塩基とすれば、どの遺伝子にも、10~20の異なった点突然変異が1万系統のどこかに存在していることになります。私たちは、1万系統の中から、特定の遺伝子上に点突然変異を持つ系統を見つけるためのDNA検査法を開発しています。すでにこのシステムは国内外で多くの研究に役立てられています。
例えば、薬の効きめに関わる遺伝子や精神疾患に関わる遺伝子がわかり、すでに論文発表されています(図参照)。このように生物学上の新たな発見だけでなく、病気の解明により私たちの健康に関わる研究推進に貢献できるよう、さまざまなENU変異マウスを提供しています。
※1: ENU:N-エチルN-ニトロソウレア。アルキル化剤の一種で、DNA配列の塩基置換を高頻度に誘発する突然変異原 ※2: 点突然変異: DNAの1塩基(G、A、T、C)が別の塩基に置き換わってしまう突然変異のこと
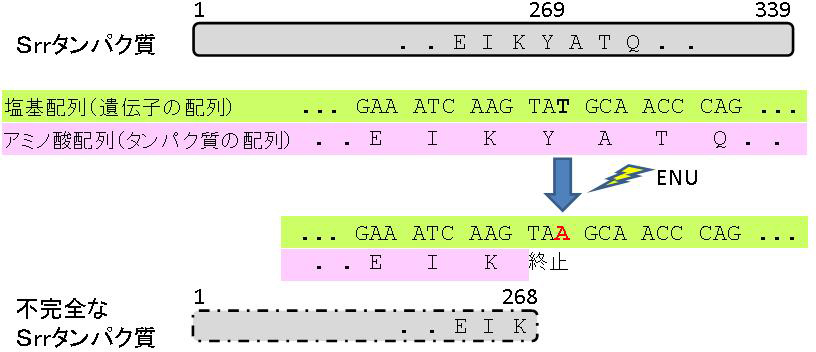
図)理研のバイオリソースから確立された疾患モデルマウスの例
339個のアミノ酸で構成されるタンパク質の遺伝子Srrに生じたENU点突然変異。三つのDNAの配列は一つのアミノ酸の暗号になっている。269番目のY(チロシン)というアミノ酸の暗号はTATだがENUにより1文字だけ突然変異しTAAになった結果、Yではなくタンパク質合成の終わりの暗号になった。 そのため、268個のアミノ酸で構成される不完全なSrrタンパク質に変化した。この不完全なSrr遺伝子を持つマウスは統合失調症様の症状を示し、疾患モデルマウスとしてこの病気の研究に役立てられている。E(グルタミン酸)、I(イソロイシン)、K(リジン)、A(アラニン)、T(スレオニン)、Q(グルタミン)はアミノ酸を示す略号。
(新規変異マウス研究開発チーム 福村 龍太郎)
体作りの台本を読み解く
「発生生物学」という言葉を知っていますか? さまざまな生き物の体ができあがるしくみを理解する学問です。
発生のしくみは「劇」に例えられます。劇には多くの役者が出演し、登場→演技→退場を繰り返して劇を進行させます。生き物の発生という劇では、遺伝子が役者で、台本は父親と母親から受け継いだゲノム情報です。遺伝子(役者)がゲノム情報(台本)に従って必要な場面と場所で働く(演技する)ことによって、赤ちゃんの体作りという劇は正しく進行するのです。そして台本には、もちろん生まれた後の体の維持に重要なせりふも書かれています。
ただし、劇の台本と発生の台本には大きな違いがあります。発生の台本であるゲノム情報は、体作りの順番にあわせて整然と書かれているわけではありません。意味不明な文字が大多数で、せりふはばらばらに散らばっています。このようなことから、生き物の体ができあがる仕組みを理解するには、膨大なゲノム情報の中から発生という劇の台本を読み解く研究が必要になります。
私たちはマウスを対象に、発生の台本にあるゲノム情報の文字をわざと書き換えるという手法を用いて研究しています。N-エチルN-ニトロソウレア (ENU)という薬剤を投与したマウスは、台本にある約30億文字のうちの数千文字がランダムに書き換えられます。その結果、一部のマウスではさまざまな臓器の形が乱れたり、臓器そのものがなくなります。つまり、ENUによってゲノム情報(台本)が書き替えられた遺伝子(役者)は、その臓器を作り上げるために重要である、ということを知ることができ、発生の台本の一部を読み解いたことになります。
ヒトとマウスは見た目に大きく違いますが、ゲノム情報や発生のしくみはよく似ています。マウスの発生の台本を読み解いた成果は、ヒトの体作りの理解につながるのです。
私たちは、ゲノム情報のたった1文字の違いで生殖器の形が乱れたマウスに出会いました。それが原因で、そのオスもメスも子どもが産めない不妊となってしまいます。 不妊はヒトカップルの約1割が悩む社会的に大きな問題で、その原因はさまざまです。私たちが出会ったマウスはその原因の一つを示しています。生殖器を形づくる台本を読み解き、ヒトとマウスの類似性をもとに、不妊の治療に結びつく研究につなげられたらと思います。
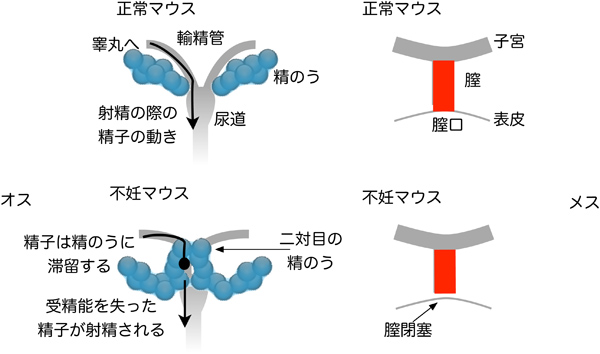
図)生殖器の形づくりの台本が1文字だけ書き替わった不妊マウスの例。
不妊マウスのオスでは、「精のう」が左右1対から2対に増えていますし、 メスでは開いているはずの膣がふさがっています。この形の違いが不妊の原因でした。本文にあるようにENUはマウスゲノム全体で数千文字をランダムに書き換えるので、どれが形作りを乱した原因なのか、このままではわかりません。しかし、その後の戻し交配という手法により、書き換わった文字をゲノム全体で1文字に減らしたため、決め手となった役者を知ることができました。
(新規変異マウス研究開発チーム 村田卓也)
発がんに形作りの遺伝子が関わる!?
私たちの体は約60兆の細胞からできています。たった一つの受精卵が何回も細胞分裂を繰り返し、単なる細胞の集まりではなくヒトの形となって生まれてきます。これを発生といいます。ヒトがヒトの形になるためにはどのようなプログラムが働くのでしょうか?
例えば、ほとんどのほ乳類は、生まれた時に親指から小指まで5本の指があります。なぜ親指と小指の位置が入れ替わったりしないのでしょうか?その仕組みが、指の数がふえてしまう「多指症」になる突然変異マウスの研究から明らかになってきました。Shhというタンパク質(※1)が、発生の初期に、将来の小指になる所で作られ親指のほうに向かって薄まっていきます(図参照)。そして、Shhタンパク質が最も濃いところに小指が、濃度が低くなるにつれ他の4本の指が作られます。図の多指症のマウスは突然変異によって、将来親指になる所でもShhタンパク質が高濃度だったため、そこに小指や薬指ができたのです。
Shhタンパク質が体の中で伝わり制御する流れを「Shhシグナル伝達系」といいます。この伝達系は、指だけでなくいろいろな臓器の形作りに重要な働きをしています。また、形作りが終わった大人の体でも、皮膚や毛の細胞において大事な働きをしていることも分かってきました。
さらに、Shhシグナル伝達系が乱れるといろいろな問題が生じることもわかってきました。例えば、日焼けが原因のひとつとなっている基底細胞がん(皮膚がんの一種)は、紫外線がこの伝達系に異常を起こした結果と言われていますし、前立腺がんや肺がん、また子供の小脳のがんの一部は、この伝達系の異常が一因と報告されています。
このように、Shhシグナル伝達系は、胎児期には体の形を作り、生後は毛や皮膚の維持に働き、それがひとたび異常になると、さまざまながんの原因にもなりうる、といった具合に、多様な役割を持っています。発生と発がんとの間には、メカニズムの点で多くの共通点があるようです。
このように突然変異マウスの開発は、基礎研究だけでなく、がんの解明にも役に立つバイオリソースになると期待されています。
※1: (注)タンパク質は、遺伝子から作られる。遺伝子に突然変異が生じるとそのタンパク質の機能に変化が生じることがある。
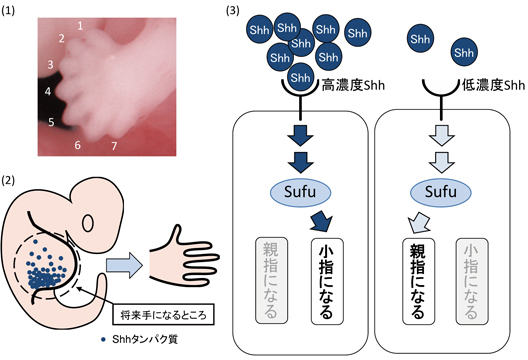
図1)Shhシグナルを伝達するSufu遺伝子の点突然変異によって多指症になったマウス胎児の前足。指が7本ある。正常なマウスはヒトと同じ5本指。
図2)手の向きを決めるメカニズムのモデル。小さいつぶがShhタンパク質。つぶの濃さによって、親指になったり小指になったりする。
図3)Shhシグナル伝達経路のモデル。Shhタンパク質の濃さによってSufuタンパク質がスイッチとなり、小指や親指が作られる。
(新規変異マウス研究開発チーム 牧野 茂)
遺伝か環境か、それとも?
今月は選抜高校野球が開催されます。スポーツや勉強に励んでいる時に、どのくらいが自分の頑張り次第で、どのくらいが遺伝的に最初から決まっているのだろうと考えたことはありませんか。
髪の色、目の色、そして、カエルからはカエルが産まれるといった、環境を変えても変わりようがない部分を「遺伝による」もしくは単純に「遺伝」といいます。ヒトはどんなに努力してもゾウより大きくはなりませんしマウスより小さくもなりません。
しかし2㍍を越えるバスケットボール選手はいますし、髪の色も日に焼けたり染めたりすれば変わります。年をとれば白髪も増えます。与えられたゲノム(=遺伝)と環境(=外的要因)で、遺伝子発現と機能は、ある範囲で変わりうるのです。
突然変異マウスの開発は、ゲノムDNAが変わると遺伝子発現がどのように変わり、生きたマウスにどのような変化が現れるか、そして、どこまでが遺伝でどこまでが環境かを知るためのモデルにもなります。
さて、ゲノムDNAの四つの塩基の並びが遺伝子となり、一つのタンパク質を発現すると、分子生物学の教科書には書いてあります。ところが、ヒトゲノム解読の結果、ヒトゲノム30億塩基の配列のうちタンパク質になる部分は、わずか1%ほどということがわかりました。残りの99%のほとんどが実は何をしているのか、まだよくわかっていません。進化の過程で勝手に増えた「利己的遺伝子(※1)」で何の働きももたない「ガラクタDNA」がその大部分だ、という説も提唱されているほどです。
3千万の点突然変異を蓄積した理研の変異マウスリソース1万系統には、タンパク質を発現するゲノム配列にも、残り99%の配列にも、同様に突然変異が生じています。もし本当に利己的遺伝子でガラクタであれば、そういった配列に点突然変異をもつマウスは普通のマウスと全く違いがないはずです。
イチローのように毎年200本以上の安打を打つために必要な動体視力を持つには、どういった遺伝子が、いつどのように機能すればいいか、それはタンパク質なのか、もしくは今ガラクタと考えられているDNAの働きなのか―近い将来、突然変異マウスの研究から明らかになるかもしれません。
※1: (注)利己的遺伝子という言葉は、リチャード・ドーキンス博士著「Selfish Gene」(1976年)によって一般にもよく知られるようになった。タイトルの日本語訳である。
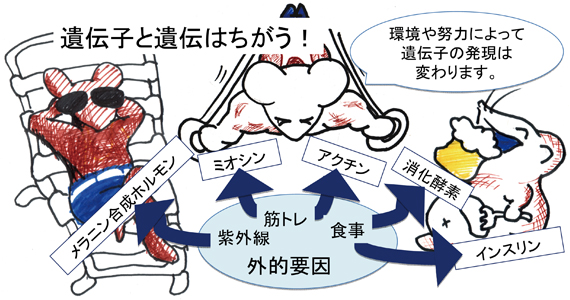
図)環境や臓器、年齢によって、ゲノムに記載された遺伝子から発現してくるタンパク質が変わります。発現する量やタイミングも変わります。紫外線を浴びると日焼けする、トレーニングで筋肉がつく、食べると太る、いずれも外的要因による変化ですが、その変化も実は遺伝子の働きで変わっているのです。
図の「アクチン」「消化酵素」は、そういった遺伝子から作られるタンパク質のごく一部です。親から受け継いだ遺伝子によっては、紫外線を浴びると皮膚がんをおこしてしまうことがあります。どんなに筋トレをしても筋肉が落ちていく筋ジストロフィー症、血糖値が上がっても元に戻らない糖尿病なども、そのような遺伝の例です。
(新規変異マウス研究開発チーム 権藤洋一)
モデルマウス:どこから来たか?
医学の研究はヒトの病気の正しい診断や効果のある治療を行うために大切ですが、いうまでもなく、ヒト自身を研究材料とすることはできません。
近代的な医学研究は1900年代に始まりましたが、ヒトが愛玩用に飼っていたマウス、ラット等が、同じ哺乳動物であるという理由で医学研究におけるヒトのモデルとなりました。メンデルの法則の再発見に始まるこの世紀には、ヒトを含む「生き物」の仕組みに「遺伝」が関係していることが明らかになりました。遺伝的に純化したマウスの系統を育てて、研究者に提供しようという事業が米国のジャクソン研究所で始まったのも、この世紀です。
モデルマウスの免疫学への貢献 20世紀の前半は、「感染」がヒトの健康にとって大きな脅威であり、感染を防ぐ免疫の仕組みの研究が盛んに行われましたが、マウスは基本的にはヒトと似た免疫の仕組みを持つことがわかり、モデルとして大変役に立ちました。
病気の遺伝子を捉える 20世紀後半、抗生物質の発達によって感染症が少なくなりヒトの寿命が延びましたが、代わりに、がん、糖尿病、高血圧症等の生活習慣病が健康を脅かすようになりました。一方、この時代になると、遺伝子をDNA分子として実験的に扱う技術や、生まれる前のマウスに目的とする遺伝子のDNA分子を注入し、生まれた個体でその働きを調べる技術が目覚しい進歩を遂げました。ヒトの正常な生命やその異常としての病気が起こる仕組みを、モデルマウスから知ることができるようになったわけです。
モデルマウスはどこから? このようにヒトの役に立つようになったマウスはどこから来たのでしょうか? アジア・ヨーロッパ大陸の野生マウスには、遺伝子から見ると約100万年前に分かれた東洋系と西洋系とがありますが(図)、東洋でも西洋でも数百年前、野生マウスから愛玩用マウスが育成されたようです。わが国でも江戸時代に愛玩用ネズミの育て方に関する本が出版されています。
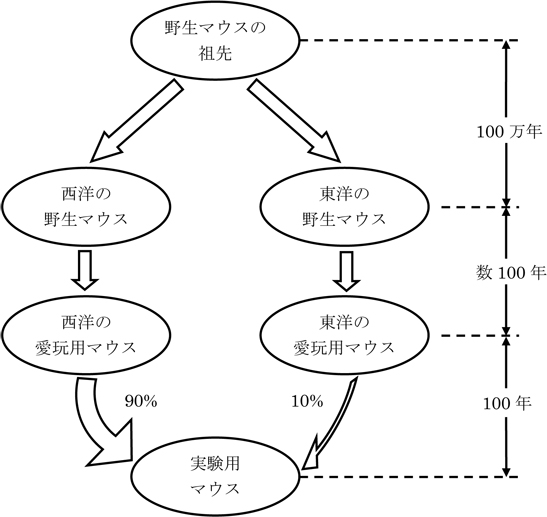
現在モデルとして使われている実験用マウスは、100年ほど前に西洋系の愛玩用マウスを主な母体として作られましたその遺伝子は90%が西洋系、10%が東洋系になっています(図参照)。我々は日本独自のマウスで日本独自の研究を進めるために、100%東洋系の遺伝子をもつ新しい実験用マウスを育てています。
(特別顧問 森脇和郎)
生きる仕組み:研究を支える役割
私たち自身「生きもの」ですが、私たちが食べ物から栄養を取り、それを使って運動したり、ものを考えたりするということだけを見ても、その「生きる仕組み」が複雑であり、しかもよくできていることがわかります。
この仕組みが正しく働かないと病気になりますが、医学が進歩した今日でも治すことのできない病気が残っているのは、この仕組みが大変複雑であることを示しています。ヒトの病気を研究し、治す方法を見つけ出すことは社会にとって非常に大切ですが、このような研究をするために、「ヒト」そのものを材料にすることはできません。
そこで、ヒトと同じ哺乳動物であるマウスをモデルとして「ヒト」の「生きる仕組み」と「病気」の研究を進めなければなりません。現在日本を含め世界中の研究者が、さまざまな種類のモデルマウスを使って、この「生きる仕組み」を研究していますが、そのためにはたくさんの種類のモデルマウスが必要です。
理研筑波研究所のバイオリソースセンターは、そのようなマウスを集めて保存し、それらがモデルとして正しい性質を持っていることを確かめた上で研究者に配るという仕事を、2001年にはじめました。現在では5000系統のマウスを持ち、その多さでその数量の多さで世界32番目のセンターになっています(図)。
ヒトだけではなく、あらゆる動物、植物、および微生物は互いに関係を持ちながら地球上の「生きもの」の社会を形作っています。それらの「生きる仕組み」は複雑であり、どれも研究の対象となります。しかし、実際にすべての「生きもの」を使って「生きる仕組み」を研究することはできないので、ここでもモデルが必要です。今日、マウスだけでなく、いろいろな動物・植物・微生物が研究のために世界中で使われており、バイオリソースと呼ばれています。
理研バイオリソースセンターではマウスのほか、次のようにいくつものバイオリソースを整え、リソースごとに専門の部門が担当して、国内外の研究者を支援しています。
- 植物を研究する大切なモデルとして、5万種類のシロイヌナズナ系統を維持。
- 薬や発酵食品の分野の研究に役に立てる2万種類の微生物系統の維持。
- 2000系統の培養細胞を保存。遺伝子や薬の働きを調べ、「組織を作る」こともできます。
- ゲノム研究に役立てるため、動植物・微生物の300万種の遺伝子DNAを保存。
- このセンターがもつすべてのリソースに関する情報を、広く日本・世界に発信します。
当センターには、これら支援の部門とともに、「生きる仕組み」を研究して、われわれが維持・保存・提供しているリソースに独自の研究用資源としての価値を与えようという六つの部門が活動しています。その中には、遺伝子の変異を持つマウスの病気を診断しようという、マウスクリニック部門もあります。
「生きる仕組み」が複雑なのは、「生きもの」の一つの性質を現すのにも複数の遺伝子が関係していることによると思われます。さらに一つ一つの遺伝子には、進化の長い歴史が影を落としています。
このように複雑な「生きもの」を相手にその「生きる仕組み」を研究するには、きわめて品質の高いリソースをモデルとして使わねばなりません。そのようなバイオリソースを用意する私たちの役目は、今後ますます大きくなることでしょう。
(特別顧問 森脇和郎)
